Das Komplementsystem
Das Komplementsystem war ursprünglich durch seine bakterizide Funktion
entdeckt worden, und zwar als ein Serumbestandteil, der die Wirkung der Antikörper
“komplementierte”. Um bakterizid zu wirken, bedarf es einer Aktivierung, z.
B. durch antigengebundene Antikörper (klassische Aktivierung) oder durch
Oberflächenstrukturen.
Insgesamt umfasst das Komplementsystem 20 Proteine, als C1-C9 bzw. Faktoren
D, B, I, H und Properdin bezeichnet (siehe Tabelle), die im Serum in
verschiedenen Konzentrationen vorliegen.
Der klassische Aktivierungsweg wurde vor dem alternativen Weg entdeckt
(deswegen "klassisch"). Entwicklungsgeschichtlich hat er sich jedoch
erst später als der alternative Weg entwickelt.
Die wesentliche Bedeutung des klassischen Komplementweges liegt in der
Aktivierung durch Antigen-Antikörper-Komplexe. Außer Ag-AK-Komplexen
aktivieren auch andere Oberflächen, wie DNA, Kollagen oder C-reaktives Protein,
das Komplementsystem über den “klassischen Weg”.Bei Aktivierung des
klassischen Weges wird über C3b immer auch der alternative Weg mitaktiviert,
wobei das Vorhandensein einer Aktivator- oder Inaktivatoroberfläche über die
Stärke der Mitaktivierung des alternativem Weges entscheidet.
Bei primärer Aktivierung des alternativen Weges wird der klassische Weg nicht
mitaktiviert.
Ablauf der Aktivierung:
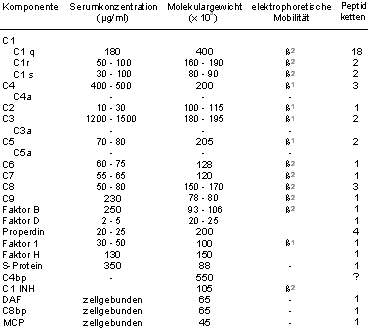
- Die erste Komplementkomponente C1 bindet mit ihrer Untereinheit C1q an die
Fc-Abschnitte zweier benachbarter Antikörper (IgG oder IgM). Dadurch
ändert die die Konformität von C1q und es lagern sich je 2 Moleküle C1r
und C1s an C1q an. Dieser Komplex wird durch Ca++ stabilisiert.
- Durch die Bindung erlangt C1s Esteraseaktivität und spaltet zwei weitere
Komplementproteine C4 (in C4a und C4b) und dieses dann C2 (in C2a und C2b).
C4b ist kurzzeitig hochreaktiv (COOH-Gruppe!) und kann mit NH2-
oder OH-Gruppen auf Aktivatoroberflächen eine kovalente Bindung eingehen.
Erfolgt keine Bindung, wird die COOH-Gruppe mit H2O abgesättigt.
An das membrangebundene C4b lagert sich C2 an, das durch aktiviertes C1s
gespalten wird.
- Die Spaltstücke des C2a und des C4b bilden zusammen ein Enzym (C2a4b),
die sogenannte C3-Konvertase. Ein Molekül spaltet viele C3-Moleküle,
so dass an dieser Stelle die Komplementaktivierung amplifiziert wird. Ein
Spaltstück des C3, das C3b, kann unmittelbar nach seiner Entstehung
kovalent an Membranen binden und führt die Komplementkaskade weiter.
(Aktivierung des alternativen Weges)
Das kleinere Spaltstück C3a wird freigesetzt.
- C3b bindet C5, das dann durch die C3-Konvertase in C5b und C5a gespalten
wird. Der Komplex C4b2a3b wird als C5-Konvertase bezeichnet.
C4a, C3a und C5a bezeichnet man als “Anaphylatoxine”,
C5a ist außerdem chemotaktisch, z. B. für Monozyten und Granulozyten.
- C5b ist nun der Ausgangspunkt für den Membranangriffskomplex
(MAC): C5b bildet mit der Komponente C6 einen Komplex, der für kurze Zeit
reversibel mit Membranen oder Lipoproteinen reagieren kann. Bindung des C7 führt
zu einem tri-molekularen Komplex, der teilweise in die Membran inseriert.
Der C5b6-7-Komplex bietet eine Bindungsstelle für C8, der daraus
resultierende C5b-8-Komplex bildet eine kleine transmembranale Pore, die
durch die Bindung vieler C9-Moleküle größer und stabiler wird.
Wirkung des MAC:
Transmembranale C5b-9-Poren stören die osmotische Kontrolle der Zelle.
Ionen und Wasser können in die Zelle eindringen, was zum Anschwellen und
schließlich Platzen der Zelle fuhrt. Bei Erythrozyten reicht eine
transmembranale Pore zur Lyse aus. Zellkern-haltige Zellen können eine
Komplementattacke abwehren, z. B. durch Internalisierung oder Abschnürung
komplementbesetzter Membranbereiche, so dass mehrere funktionelle Kanäle zur
Abtötung gebraucht werden. In sub-lytischer Dosis vermitteln membranständige
C5b-9-Komplexe auch transmembranale Signale. Bei vielen Zellen wurde eine
Freisetzung von Eicosanoiden oder Zytokinen
beobachtet.
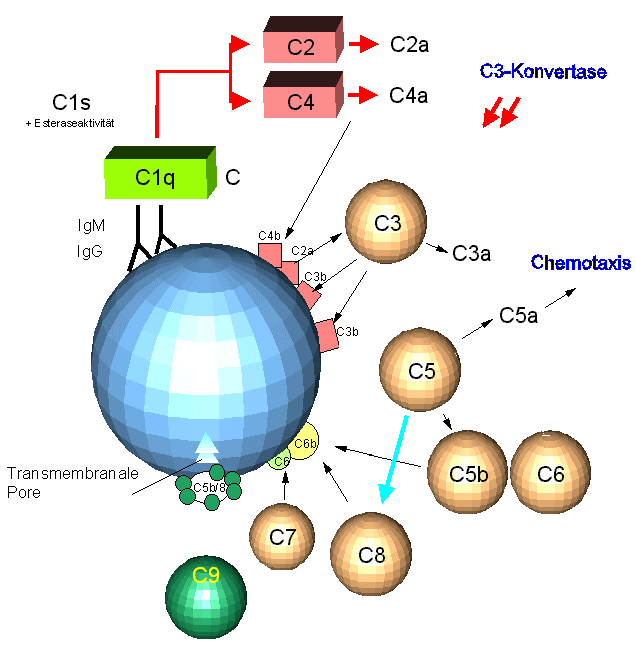
Der alternative Aktivierungsweg (“Properdinsystem”) kann durch
sog. Aktivatoroberflächen (bakterielle Proteasen, lysosomale Enzyme,
Plasmaproteinasen und Granulozytenelastase) in Gang gesetzt werden. Er läuft
unabhängig von den Komponenten C1, C2 und C4 ab.
Genau genommen ist für den alternativen Weg keine Aktivierung notwendig.
Vielmehr beruht er auf einer Hemmung der Regulation.
Voraussetzung für eine alternative Aktivierung ist das Zusammentreffen einer
geringen Menge C3b und einer geeigneten Oberfläche. Dieses C3b wird durch
folgenden Vorgang bereitgestellt:
- C3 bindet an eine Mikrobenoberfläche und ändert dabei seine Struktur
derart, dass es Oberflächenstrukturen freilegt, die C3b entsprechen. Es
entsteht iC3 ("identical").
- An iC3 lagert sich nun Faktor B an, es entsteht der Komplex iC3-B. Durch
diese Bindung wird B so verändert, dass er durch den im Serum in aktiver
Form vorkommenden Faktor D gespalten werden kann. Das Resultat ist der
Komplex iC3Bb, der als C3-Konvertase des alternativen Weges (Sparflammenkonvertase)
bezeichnet wird.
- Der Komplex iC3Bb spaltet ein weiteres C3-Molekül, wodurch (endlich) C3b
entsteht. C3b durchläuft ab Punkt 2 wiederum den eben beschriebenen
Aktivierungsweg (autokatalytische Schleife).
Wenn C3b nicht innerhalb kürzester Zeit an eine entsprechende Oberfläche
binden kann, wird es durch H2O abgesättigt und tritt als
unwirksames "fluid-phase-C3b" im Plasma auf.
- Es entsteht ein neues Enzym C3bBb, das, stabilisiert durch Faktor P (Properdin),
weitere C3-Moleküle spalten kann. (Der Komplex heißt nun C3bBbP)
- Ähnlich wie die C3-Konvertase des klassischen Weges spaltet C3bBbP auch
C5 (C5-Konvertase des alternativen Weges), das an ein weiteres
C3b-Molekül gebunden ist. Es entstehen C5a und C5b.
- C5b ist wiederum der Ausgangspunkt für den Membranangriffskomplex
(MAC); hier münden also klassischer und alternativer Weg in eine gemeinsame
Endstrecke.
An Aktivatoroberflächen können die Komplement-Regulatorproteine I und H,
deren Aufgabe die Spaltung und damit Inaktivierung des C3b ist, nicht wirksam
werden. Der alternative Reaktionsweg kann durch Immunglobulin wie IgA und IgE,
Zymosam oder Lipopolysaccharide wie Endotoxine induziert werden.
Inhibitoren und Kontrolle des Komplementsystems
Der raschen und nahezu ubiquitären Aktivierbarkeit des Komplementsystems
stehen eine Reihe effektiver Regulatoren gegenüber, die an verschiedenen
Stellen der Komplementsequenz eingreifen:
- Ein Faktor ist die kurze Halbwertszeit der C3- bzw. C5-Konvertasen (einige
Minuten)
- Gut untersucht sind der C1-Esterase-Inhibitor (C1-INH), ein Serumprotein,
das die Aktivität des aktivierten C1 bzw. C1s kontrolliert, indem es mit
C1r,s einen Komplex bindet, der die Bindung an C1q verhindert. C1-INH liegt
mit einer Serumkonzentration von etwa 300 mg/l vor. Sein Fehlen ist mit der
Manifestation des hereditären angioneurotischen Ödems assoziiert.
- Inhibitoren der C3/C5-Konvertasen:
- Die Faktoren I und H spalten aktiviertes C3b
- Ein weiteres Serumprotein, S-Protein oder Vitronektin, bindet an
C5b6-Komplexe und verhindert damit ihre Anlagerung an die Membran.
- Außer den Serumproteinen gibt es auch membranständige Proteine mit
Regulatorfunktion
- wie MCP (engl. “Membrane Cofactor Protein”,
auch "Membran Control Protein")
- CR1 (C3-Rezeptor), inaktiviert zusammen mit Faktor H das C3b
(ersatzweise für Faktor I)
- “Decay Accelerating Factor”, DAF, hemmt den
Aufbau der C3-Konvertasen .
- C8-bindende Protein (C8bp oder HRF) inhibiert die Komplementlyse auf
der Ebene der späten Komponenten.
DAF und C8bp hemmen im homologen System, d. h., wenn Komplement und
Zielmembran der gleichen Spezies entstammen.
Die biologische Funktion des Komplementsystems zeigt sich besonders bei
Krankheitsprozessen, bei denen zytotoxische oder durch Immunkomplexe vermittelte
gewebszerstörende Mechanismen ablaufen. So spielt das Komplement nicht nur bei
der Abwehr von Infektionen eine zentrale Rolle, sondern ebenso bei der
Manifestation z.B. immunkomplexinduzierter Autoimmunerkrankungen.
| Mangel an |
Pathologie / Symptomatik |
| C1q, r, s, C4 |
- sehr selten, assoziiert mit Immunkomplexerkrankungen (SLE-ähnliche
Symptomatik)
- häufig Infektionen mit pyogenen Bakterien
|
| C2 |
häufig SLE-Symptomatik,
geringe Infektionsneigung |
| C3 |
häufig Infektionen mit pyogenen Bakterien |
| Faktor I |
häufig Infektionen mit pyogenen Bakterien |
| C5-C8 |
- häufig Infektionen mit Meningo-, Pneumo-, Gonokokken
- selten Vaskulitis
|
| C9 |
kein Einfluss auf Komplementwirkung (häufig in Japan!) |
| B |
nicht mit dem Leben vereinbar (Symptomatik daher unbekannt) |
| DAF |
paroxysmale nächtliche
Hämoglobinurie |



